L’évolution de la fibrose hépatique est totalement asymptomatique et va évoluer progressivement et silencieusement vers une cirrhose . Cette évolution se déroule sur plusieurs années. La cirrhose peut-être alors découverte fortuitement à l’occasion d’un examen clinique ou devant des anomalies des tests hépatiques effectués systématiquement.
À un stade précoce, la cirrhose est compensée cela veut dire que la cirrhose est asymptomatique car un équilibre persiste et aucune complication n’apparait. C’est pour cela que le patient peut ne présenter aucun signe clinique particulier alors que la maladie est présente. L’examen clinique doit donc systématiquement rechercher des signes d’insuffisance hépato-cellulaire et d’hypertension portale.
Les signes d’insuffisance hépato-cellulaire
A l’interrogatoire, le patient peut se plaindre d’une inversion du cycle nycthéméral, ayant des difficultés à dormir la nuit mais étant somnolant la journée.
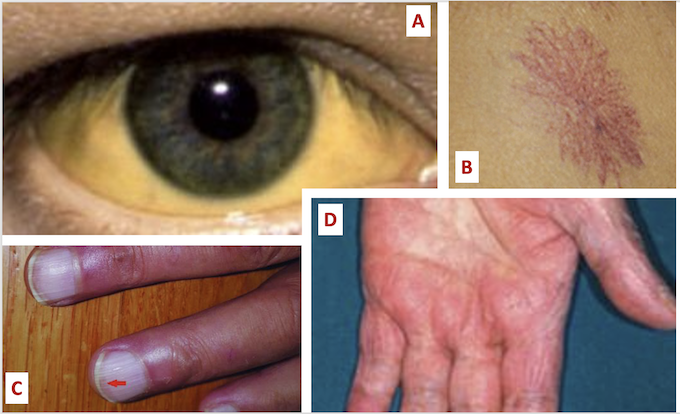
A l’inspection, On peut observer des angiomes stellaires qui sont de petites taches couleur rouge rubis, constituées d’un vaisseau central dilaté entouré de plus petits vaisseaux sanguins formant une étoile. Ces angiomes prédominent à la partie supérieure du thorax et qui sont caractérisés par le fait qu’ils s’effacent à la pression et qui se recolorent du centre vers la périphérie.
Au niveau des mains on peut remarquer une érythrose palmaire associée à des ongles blancs appelée aussi leuconychie. Il s’agit d’une coloration blanche de la tablette unguéale avec une fine bande plus foncée au niveau distal.
Un ictère conjonctival ou cutané peut exister (Figure n°1).
A la palpation le foie peut-être palpable réalisant ainsi une hépatomégalie, il est le plus souvent de consistance ferme ou dure avec un bord inférieur irrégulier, dit tranchant. Il est parfois de petite taille paradoxalement témoignant d’une cirrhose de Laennec qui correspond à une cirrhose atrophique du foie le plus souvent d’origine alcoolique.
L’examen des mains, les bras étendus en avant peuvent mettre en évidence un astérixis ou flapping tremor, correspondant à des mouvements successifs de flexion-extension des poignets et de flexion-latéralisation des doigts, lents, irréguliers et de grande amplitude, évoquant des battements d’ailes de papillon. Ce signe très spécifique d’une insuffisance hépato-cellulaire est dus à l’interruption brusque, brève et involontaire du tonus postural (Figure n°2).

Ce signe est très évocateur d’encéphalopathie hépatique pouvant évoluer vers des signes de confusion, voire des troubles de la conscience.
Enfin un fœtor hepaticus doit-être recherché correspondant à une odeur de l’haleine douceâtre et écœurante, rappelant celle de la pomme pourrie.
Les signes d’hypertension portale
A coté des signes liés à une insuffisance hépatocellulaire, des signes d’hypertension portale peuvent être présents
A l’inspection, on peut observer une dilatation des veines sous-cutanées abdominales représentant la circulation veineuse collatérale pouvant constituer une véritable « tête de méduse » au niveau de l’ombilic réalisant le syndrome de Cruveilhier-Baumgarten (Figure n°3).
A la palpation on peut retrouver un thrill et l’auscultation un souffle vasculaire continu, de type veineux, en regard du ligament rond au niveau de l’ombilic lié à la circulation veineuse collatérale.
On recherchera à la palpation une splénomégalie.

Examens biologiques
Les examens biologiques hépatiques (AST, ALAT, bilirubine totale, γ-GT, phosphatases alcalines) peuvent être normaux. Mais on observe souvent une élévation modérée des transaminases et de la γ-GT pouvant bien sur être lié aussi à la pathologie initiale ayant entrainé la cirrhose du foie.
Biologiquement l’insuffisance hépatique se traduit par :
- une diminution des facteurs de coagulation (taux de prothrombine (TP) et facteur V) ;
- une élévation de l’INR ;
- une diminution de l’albuminémie ;
- une élévation de la bilirubinémie.
L’hypertension portale s’accompagne d’un hypersplénisme qui va donc entrainer une baisse des plaquettes ou thrombopénie le plus souvent. Il peut exister une baisse des globules blancs (leucopénie) ou une baisse des globules rouges (anémie) mais moins fréquemment.
Une augmentation du volume globulaire (macrocytose) ainsi qu’un bloc β-γ sur l’électrophorèse des protéines (fusion entre les pics correspondant normalement aux β et γ-globulines) peut être observé et orienter vers une cirrhose secondaire à une consommation excessive d’alcool.
Examen d’endoscopie digestive
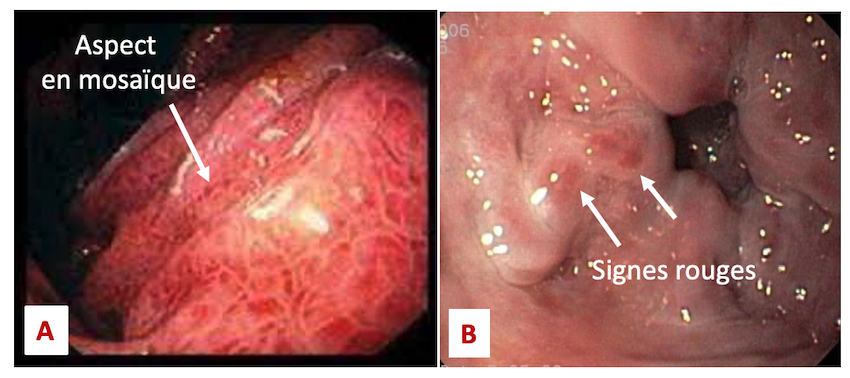
Devant un bilan d’une cirrhose compensée il faut obligatoirement réaliser une endoscopie digestive haute ou gastroscopie, afin de recherche la présence de signe varices œsophagiennes. En effet, elles peuvent être déjà présentes du à l’hypertension portale et nécessiter une prise en charge endoscopique afin d’éviter des hémorragies digestives par ruptures. On recherchera aussi des signes de Gastropathie d’Hypertension portale avec un aspect en mosaïque spécifique (Figure n°4 A et B).
Examens radiologiques et biopsies hépatiques
L’échographie abdominale est l’examen d’imagerie de première intention à faire chez tous les patients atteints de cirrhose. L’échographique confirmera une irrégularité des contours du foie (dysmorphie) avec une atrophie souvent le lobe droit et une hypertrophie souvent le lobe gauche et une splénomégalie (Figure n°4-A) .
Elle est très importante car elle pourra mettre en évidence une cirrhose décompensée devant la présence d’une lame d’ascite non perçue lors de l’examen clinique voir d’emblée un carcinome hépato-cellulaire.
Le Scanner Abdominal, objective avec plus de précision la présence de liquide dans la cavité péritonéale sous la forme d’image liquidienne hypodense autour du foie et de la rate (Figure n°4-B)

La biopsie hépatique n’est plus indispensable mais l’examen histologique permet d’affirmer l’existence d’une cirrhose et d’objectiver parfois des lésions en rapport avec sa cause. Il peut être obtenu à partir d’une biopsie percutanée ou transjugulaire selon qu’il existe ou non de l’ascite et/ou des troubles de l’hémostase.
Actuellement Les tests sanguins types (Fibrotest® et Fibrometre®) donnent une estimation semi-quantitative du degré de fibrose de même que le Fibroscan®.
Les scores pronostiques
Des scores pronostiques sont utilisés en pratique courante pour suivre l’évolution de la cirrhose : le score de Child-Pugh et le MELD.
Le score de Child-Pugh est un score largement validé et simple d’utilisation. Bien que comprenant deux variables subjectives, c’est un score souvent utilisé pour prédire la survie des patients cirrhotiques.
Les 5 variables pour le calcul du score de Child-Pugh sont l’encéphalopathie, l’ascite, la bilirubinémie, l’albuminémie et le taux de prothrombine.

Le MELD (Model for end stage liver disease) est un score pronostique plus objectif, qui nécessite toutefois un logiciel de calcul. Il s’est imposé pour déterminer l’ordre de priorité pour la transplantation hépatique. Il est calculé par une transformation logarithmique à partir de 3 variables de laboratoire, la bilirubine totale, la créatinine et l’INR, selon la formule suivante :
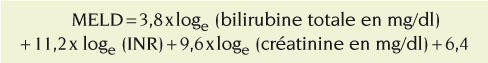
La cirrhose va obligatoirement évoluer dans le temps surtout si la cause perdure. Ainsi par la suite une ascite, un ictère, une encéphalopathie hépatique et/ou une hémorragie digestive peuvent survenir. La cirrhose passe alors d’un stade compensée à une stade décompensée. Le carcinome hépatocellulaire est une complication de la cirrhose indépendante du stade de la cirrhose.
Références :
- Afdhal NH, Nunes D. Evaluation of liver fibrosis: a concise review. Am J Gastroenterol 2004;99(6):1160-74.
- Angulo P. Nonalcoholic fatty liver disease. N Engl J Med 2002;346:1221-31.
- Angulo P, Hui JM, Marchesini G, Bugianesi E, George J, Farrell GC, et al. The NAFLD fibrosis score: a noninvasive system that identifies liver fibrosis in patients with NAFLD. Hepatology 2007;45(4):846-54.
- Bacon B.R, Adams P.C, Kowdley K.V, Powell L.W, Tavill A.S. Diagnosis and Management of Hemochromatosis: 2011 Practice Guideline by the American Association for the Study of Liver Diseases. Hepatology. 2011 ;54(1):328-43.
- Blanc JF, Bioulac-Sage P, Balabaud C, Desmoulière A. Investigation of liver fibrosis in clinical practice. Hepatol Res 2005;32(1):1-8.
- Borroni G, Ceriani R, Cazzaniga M, Tommasini M, Roncalli M, Maltempo C, et al. Comparison of simple tests for the non-invasive diagnosis of clinicallly silent cirrhosis in chronic hepatitis C. Aliment Pharmacol Ther 2006;24(6):797-804.
- Cadranel JF. Practices of liver biopsy in France: results of a prospective nationwide survey. For the Group of Epidemiology of the French Association for the Study of the Liver (AFEF). Hepatology 2000;32:477-81.
- EASL clinical practice guidelines for the management of patients with decompensated cirrhosis. J Hepatol 2018; 69:406-60.
- Este C, et al. Modeling NAFLD disease burden in China, France, Germany, Italy, Japan, Spain, United Kingdom, and United States for the period 2016–2030. J Hepatol 2018; 69:896-904.
- Ghany M,Strader D.B, Thomas D.L, Seeff L.B. Diagnosis, Management, and Treatment of Hepatitis C Hepatology 2009:49 (4):1335-1374.
- Lavanchy D. Hepatitis B virus epidemiology, disease burden, treatment, and current and emerging prevention and control measures. J Viral Hepat 2004;11(2):97-107.
- Lindor KD, Gershwin ME, Poupon R, Kaplan M, Bergasa NV, Heathcote EJ; American Association for Study of Liver Diseases.Primary biliary cirrhosis. Hepatology. 2009 Jul;50(1):291-308.
- Lok ASF, McMahon BJ. Chronic hepatitis B. Hepatology 2007;45:507- 539.
Mandayam S, Jamal MM, Morgan TR. Epidemiology of alcoholic liver disease. Semin Liver Dis 2004;24:217-232. - Manns M.P, Czaja A.J, Gorham J.D. Diagnosis and Management of Autoimmune Hepatitis. Hepatology. 2010 ;51(6):1-31.
- Regev A, Berho M, Jeffers LJ, Milikowski C, Molina EG, Pyrsopoulos NT, et al. Sampling error and intraobserver variation in liver biopsy in patients with chronic HCV infection. Am J Gastroenterol 2002;97(10):2614-8.
- Roberts E.A, Schilsky M.L. Diagnosis and Treatment of Wilson Disease: An Update. Hepatology. 2008 ;47(6) :2089-111.
- Teli MR, Day CP, Burt AD, Bennett MK, James OF. Determinants of progression to cirrhosis or fibrosis in pure alcoholic fatty liver. Lancet 1995;346:987-990.

