Comment se déroule l’infection par l’hépatite C ?
L’infection par le virus de l’hépatite C va entraîner obligatoirement une hépatite aiguë. L’organisme va pouvoir par la suite, seulement dans 10 à 40 % des cas, détruire spontanément le virus. C’est donc chez une majorité de personnes infectées que l’organisme ne réussit pas à éliminer le virus et que l’infection devient alors chronique : on parle d’hépatite virale C chronique (Figure n°1).
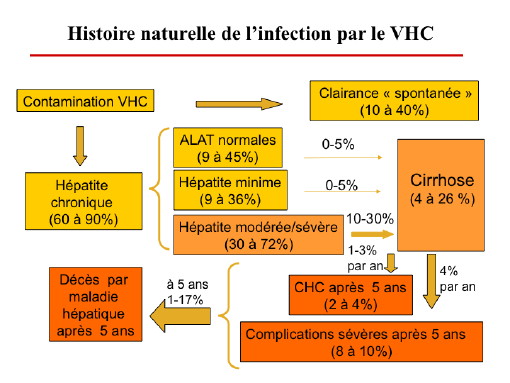
A la suite d’une infection aiguë, 60 à 90 % des personnes développent une infection chronique, avec des différences selon les types d’hépatites chroniques : ALAT normales, minime et modérée à sévère, que nous détaillerons par la suite.
Sur le plan biologique, l’hépatite virale C chronique est définie par la présence d’une PCR du virus C depuis au moins 6 mois. La cirrhose apparaît par la suite chez 4 à 26 % des patients infectés de façon chronique. Il faut plusieurs années à une infection chronique pour pouvoir développer une cirrhose et donc un cancer du foie.
L’hépatite virale C aiguë
L’hépatite virale C aiguë passe le plus souvent inaperçue, environ 90 % des personnes infectées ne présentent pas ou peu de symptômes. Les symptômes, s’il existent, ne sont pas spécifiques et associent une fatigue, des nausées, parfois une douleur de l’hypochondre droit. Seul 10 % des patients auront un ictère (jaunisse) suivies de l’apparition d’urines foncées et de selles décolorées.
Le diagnostic clinique de l’hépatite aiguë C est donc rarement fait.
A coté de cette forme classique, exceptionnellement, l’hépatite aiguë peut être sévère avec un ictère important. La forme fulminante associant des troubles de la conscience témoignant d’une insuffisance hépatique grave ne semble pas exister au cours d’une hépatite virale C aiguë.
Le premier marqueur biologique de l’infection par le virus de l’hépatite C est l’apparition de l’ARN viral qui est détectable dans le sérum par PCR (Polymerase Chain Reaction) qui est une technique de biologie moléculaire complexe. Cette technique est très fiable et met en évidence dans le sang le génome du virus (ARN). La PCR est positive dès la première semaine après la contamination.
Depuis Janvier 2008 la technique la plus sensible dite de « polymérisation en chaîne » (PCR) en temps réel qui a une sensibilité avec un seuil de détection d’environ 50 copies/ml est utilisée.
Les anticorps anti-VHC sont mis en évidence par les tests ELISA (enzyme-linked immunosorbent assay) qui détectent un mélange d’anticorps dirigés contre les protéines constitutives du virus de l’hépatite C. Ils sont détectables plus tardivement, dans 50 à 70 % des cas à partir de la 6ieme semaine après la contamination. Mais il arrive qu’ils soient présent plus tardivement pratiquement 3 à 6 semaines après le pic des transaminases.
Les transaminases (ALAT et ASAT) s’élèvent avant l’apparition des symptômes à partir de la 4ieme semaine après la contamination pour avoir un pic vers la 6ieme semaine. Le pic des transaminases est le plus souvent supérieur à dix fois la normale.

En cas de guérison de l’hépatite aiguë C, les transaminases se normalisent à la 10 ieme semaine et l’ARN viral devient indétectable entre la 10ieme et 12ieme semaine. Les anticorps anti-VHC diminuent lentement mais restent détectables dans la grande majorité des cas pendant de nombreuses années voire le plus souvent souvent toute la vie dans le sang.
La guérison de l’hépatite virale C ne protège pas définitivement d’une réinfection possible au cours d’une nouvelle contamination.
L’hépatite virale C chronique
On peut distinguer trois tableaux d’hépatite chronique C :
L’hépatite chronique à transaminases normales est définie par la présence d’un ARN viral détectable par PCR mais des transaminases (ALAT) normales sur 3 prélèvements différents effectués durant une période de 6 mois. Cette hépatite chronique à transaminases normales existe chez 10 à 40 % des patients qui ont une infection chronique par le virus de l’hépatite C. Ces patients n’ont habituellement aucun symptôme clinique mais 90 % ont tout de même des lésions histologiques sur la biopsie hépatite mais qui reste le plus souvent minime.

L’hépatite chronique minime existe chez 50 % des patients atteints d’hépatite chronique C. Ils présentent des transaminases (ALAT, ASAT) très modérément élevées, parfois fluctuantes et qui peuvent transitoirement redevenir normales. La biopsie hépatique montre des lésions d’activité et de fibrose minimes. Ces patients restent généralement asymptomatiques mais peuvent présenter une asthénie (fatigue). Ce type d’hépatite chronique C évolue généralement très lentement.
L’hépatite chronique modérée ou sévère apparaît chez 25 % des patients atteints d’hépatite chronique C. Ces patients restent asymptomatiques mais peuvent présenter une asthénie (fatigue). Les transaminases sont plus élevées que les patients atteints d’hépatite chronique minime. La biopsie hépatique montre des lésions plus marquées d’activité et une fibrose plus ou moins importante.
On estime qu’environ 20 % des malades atteints d’hépatite chronique virale C développeront une cirrhose en 20 ans.
Il faut bien comprendre que le retentissement hépatique qu’aura occasionné le virus ne pourra être évalué qu’avec une étude du foie. Cette étude du foie peut être réalisée par une analyse d’un fragment du tissu hépatique que nous pouvons récupérer lors d’une Ponction Biopsie Hépatique (PBH). Actuellement nous pouvons utiliser des marqueurs non invasifs de la fibrose hépatique comme le Fibrotest et/ou le Fibroscan qui évite la réalisation d’une PBH.
Références :
- EASL Clinical Practice Guidelines: Management of hepatitis C virus infection. J Hepatol. 2014;60:392-420.
- EASL Clinical Practice Guidelines: Management of hepatitis C virus infection J Hepatol. 2011;55:245–264.
- Esteban JI, Sauleda S, Quer J. The changing epidemiology of hepatitis C virus infection in Europe. J Hepatol 2008;48:148–162.
- Santantonio T, Wiegand J, Gerlach JT. Acute hepatitis C: current status and remaining challenges. J Hepatol 2008;49:625–633.
- Afdhal NH. The natural history of hepatitis C. Semin Liver Dis 2004;24: 3–8.
- Thompson CJ, Rogers G, Hewson P, Wright D, Anderson R, Cramp M, et al. Surveillance of cirrhosis for hepatocellular carcinoma: systematic review and economic analysis. Health Technol Assess 2007;11:1–206.
- Yang JD, Roberts LR. Hepatocellular carcinoma: a global view. Nat Rev Gastroenterol Hepatol 2010;7:448–458.
- Bartosch B, Thimme R, Blum HE, Zoulim F. Hepatitis C virus-induced hepatocarcinogenesis. J Hepatol 2009;51:810–820.
- Deuffic-Burban S, Deltenre P, Louvet A, Canva V, Dharancy S, Hollebecque A, et al. Impact of viral eradication on mortality related to hepatitis C: a modeling approach in France. J Hepatol 2008;49:175–183.
- Deuffic-Burban S, Babany G, Lonjon-Domanec I, Deltenre P, Canva-Del- cambre V, Dharancy S, et al. Impact of pegylated interferon and ribavirin on morbidity and mortality in patients with chronic hepatitis C and normal aminotransferases in France. Hepatology 2009;50:1351–1359.
