L’ascite est une accumulation de liquide dans l’abdomen qui apparait comme une complication d’une cirrhose du foie. Elle apparait dans la cavité péritonéale lorsqu’il existe à la fois une hypertension portale et une insuffisance hépato-cellulaire. Elle témoigne d’un tournant évolutif de la maladie.
L’ascite se développe chez 30 % environ des patients ayant une cirrhose. Elle peut évoluer vers une ascite réfractaire dans 10 % des cas voir même dans 4 à 10 % vers un syndrome hépatorénal.
Diagnostic d’une ascite
L’ascite peut s’installer de différentes manières. Soit elle apparaît rapidement lors d’une hémorragie digestive qui entraine une décompensation œdémato-ascitique et qui démasque la maladie. Soit l’ascite apparait d’une façon progressive alors précédée d’un météorisme abdominal. En général, si elle est isolée, elle bien tolérée, elle est responsable d’une sensation de pesanteur abdominale qui s’accompagne d’une prise de poids et d’une augmentation du périmètre ombilical.
Examen clinique
Si l’ascite est de grande abondance, elle est mal tolérée et souvent responsable d’un essoufflement (dyspnée). L’inspection met en évidence une distension de l’abdomen avec une peau tendue et lisse. L’ombilic est déplissé. La percussion retrouve une matité de tout l’abdomen (Figure n°1).
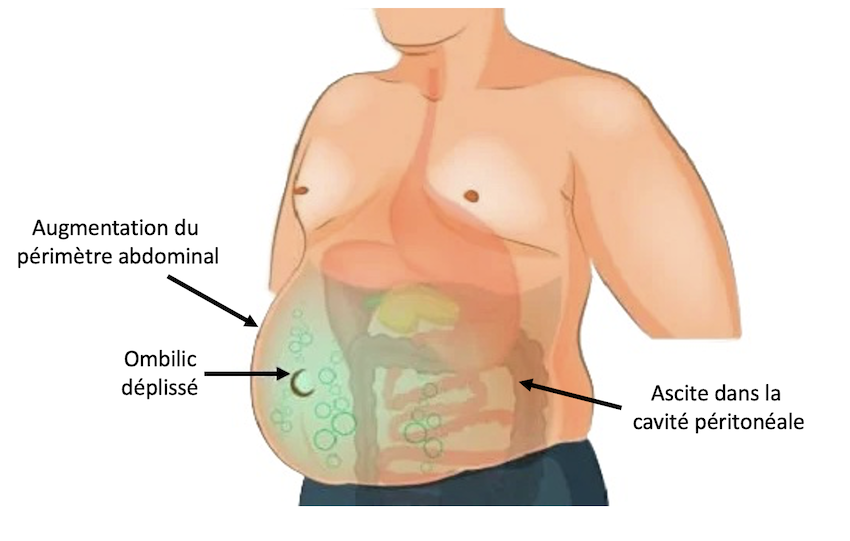
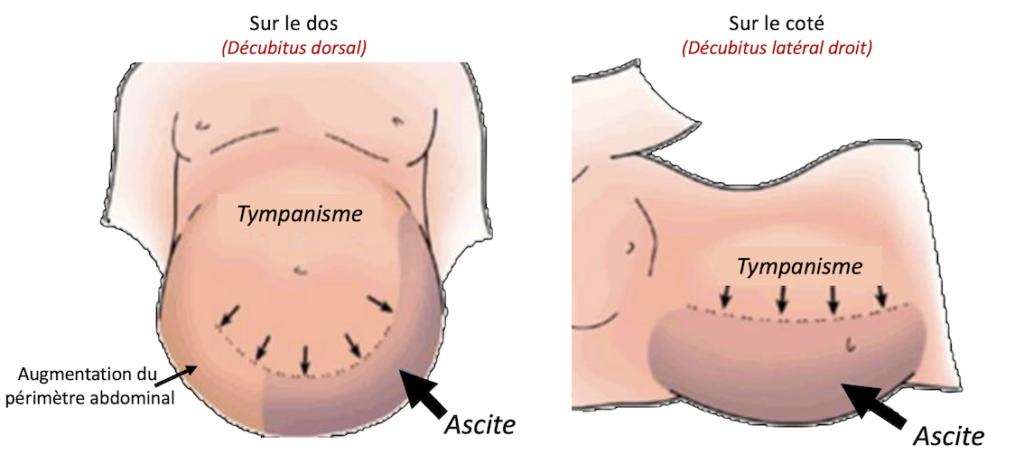
Si l’ascite est de faible ou de moyenne abondance on ne retrouve qu’une matité des flancs sur le patient qui est mis en décubitus dorsal. Cette matité se déplace vers le flanc déclive en décubitus latéral : c’est donc une matité déclive et mobile. Attention, pour obtenir une matité déclive il faut au moins un volume d’ascite de 1,5 litres. (Figure n°2).
On recherche à la palpation le signe du glaçon qui correspond au fait que lorsque nous appuyons fortement sur la paroi abdominale l’ascite par choc refoule le foie qui flotte et qui revient en entrainant un choc en retour au niveau de la main qui a appuyé.
Nous pouvons aussi observer le signe du flot. Si l’on donne un choc sur un flanc cela déclenche une onde liquidienne qui peut être perçue à distance qui correspond à l’onde qui été transmise par l’ascite
Parfois il peut apparaitre une extériorisation d’une hernie ombilicale ou inguinale qui amène à découvrir l’ascite.
Examen radiologique
L’Abdomen Sans Préparation (ASP) met en évidence une grisaille diffuse qui masque l’air présent dans les anses de l’intestin grêle qui peuvent apparaître dans ce contexte distendues (Figure n°3).

L’échographie abdominale peut mettre en évidence l’ascite sous la forme d’une lame (Figure n°4-A) et est donc très surtout utile en cas d’épanchement de faible abondance, montrant alors une image liquidienne hypo-échogène caractéristique autour du foie et de la rate.
Le Scanner Abdominal, objective avec plus de précision la présence de liquide dans la cavité péritonéale sous la forme d’image liquidienne hypodense autour du foie et de la rate (Figure n°4-B)

Ponction d’ascite
La ponction d’ascite nécessite une asepsie rigoureuse. L’aiguille est introduire au niveau du 1/3 externe de la ligne reliant l’ombilic à l’épine iliaque antéro-supérieure gauche, après désinfection large de la paroi abdominale (Figure n°5 A et B).

Le liquide obtenu à la ponction est le plus souvent un liquide jaune citron mais l’aspect macroscopique est très peu spécifique et ne peut en aucun cas se substituer à l’analyse biochimique et cytologique.
Analyse du liquide d’ascite
L’examen de première intention est l’analyse du taux de protides. Le seuil de 25g/L est retenu pour discriminer exsudat (taux de protides >25g/L) et transsudat (taux de protides < 25 g/L). L’ascite de la cirrhose est habituellement pauvre en protides et est donc un transsudat.
Il est utile de calculer le gradient d’albumine entre le sérum et l’ascite (différence entre le taux plasmatique d’albumine et le taux en protéines de l’ascite) qui, s’il est > 11 g/L, est très spécifique d’une ascite liée à une cirrhose (Tableau n°1).

Le comptage des polynucléaires (Analyse cytologique) doit être réalisée systématiquement pour écarter une infection spontanée du liquide d’ascite, complication fréquente de la cirrhose qui est asymptomatique dans plus de 20% des cas. En effet, seule l’ascite de la cirrhose peut s’infecter spontanément et elle peut mettre en jeu le pronostic vital à court terme. Tout retard de diagnostic peut s’accompagner d’une augmentation de la mortalité.
L’infection spontanée du liquide d’ascite est définie par un taux de polynucléaires neutrophiles (PNN)> 250/mm3 en l’absence de toute infection intra-abdominale contiguë. En cas de liquide hémorragique, il faut demander un dosage de l’hématocrite qui écarte un hémopéritoine s’il est < 1%. Un taux très élevé de PNN (plusieurs milliers/mm3) devra faire rechercher une perforation d’organe creux.
Une Analyse bactériologique doit-être de principe demandée. On réalise systématiquement un ensemencement dans des flacons d’hémocultures aéro et anaérobie et sur milieu de Löwenstein. Le milieu Löwenstein est un milieu de culture pour la culture du Mycobacterium tuberculosis.
Références :
- Afdhal NH, Nunes D. Evaluation of liver fibrosis: a concise review. Am J Gastroenterol 2004;99(6):1160-74.
- Angulo P. Nonalcoholic fatty liver disease. N Engl J Med 2002;346:1221-31.
- Angulo P, Hui JM, Marchesini G, Bugianesi E, George J, Farrell GC, et al. The NAFLD fibrosis score: a noninvasive system that identifies liver fibrosis in patients with NAFLD. Hepatology 2007;45(4):846-54.
- Bacon B.R, Adams P.C, Kowdley K.V, Powell L.W, Tavill A.S. Diagnosis and Management of Hemochromatosis: 2011 Practice Guideline by the American Association for the Study of Liver Diseases. Hepatology. 2011 ;54(1):328-43.
- Blanc JF, Bioulac-Sage P, Balabaud C, Desmoulière A. Investigation of liver fibrosis in clinical practice. Hepatol Res 2005;32(1):1-8.
- Borroni G, Ceriani R, Cazzaniga M, Tommasini M, Roncalli M, Maltempo C, et al. Comparison of simple tests for the non-invasive diagnosis of clinicallly silent cirrhosis in chronic hepatitis C. Aliment Pharmacol Ther 2006;24(6):797-804.
- Cadranel JF. Practices of liver biopsy in France: results of a prospective nationwide survey. For the Group of Epidemiology of the French Association for the Study of the Liver (AFEF). Hepatology 2000;32:477-81.
- EASL clinical practice guidelines for the management of patients with decompensated cirrhosis. J Hepatol 2018; 69:406-60.
- Este C, et al. Modeling NAFLD disease burden in China, France, Germany, Italy, Japan, Spain, United Kingdom, and United States for the period 2016–2030. J Hepatol 2018; 69:896-904.
- Ghany M,Strader D.B, Thomas D.L, Seeff L.B. Diagnosis, Management, and Treatment of Hepatitis C Hepatology 2009:49 (4):1335-1374.
- Lavanchy D. Hepatitis B virus epidemiology, disease burden, treatment, and current and emerging prevention and control measures. J Viral Hepat 2004;11(2):97-107.
- Lindor KD, Gershwin ME, Poupon R, Kaplan M, Bergasa NV, Heathcote EJ; American Association for Study of Liver Diseases.Primary biliary cirrhosis. Hepatology. 2009 Jul;50(1):291-308.
- Lok ASF, McMahon BJ. Chronic hepatitis B. Hepatology 2007;45:507- 539.
Mandayam S, Jamal MM, Morgan TR. Epidemiology of alcoholic liver disease. Semin Liver Dis 2004;24:217-232. - Manns M.P, Czaja A.J, Gorham J.D. Diagnosis and Management of Autoimmune Hepatitis. Hepatology 2010 ;51(6):1-31.
- Regev A, Berho M, Jeffers LJ, Milikowski C, Molina EG, Pyrsopoulos NT, et al. Sampling error and intraobserver variation in liver biopsy in patients with chronic HCV infection. Am J Gastroenterol 2002;97(10):2614-8.
- Roberts E.A, Schilsky M.L. Diagnosis and Treatment of Wilson Disease: An Update. Hepatology 2008 ;47(6) :2089-111.
- Teli MR, Day CP, Burt AD, Bennett MK, James OF. Determinants of progression to cirrhosis or fibrosis in pure alcoholic fatty liver. Lancet 1995;346:987-990.
